Физические свойства этиленгликоля C2h5(OH)2 — водный раствор (антифриз)
Физические свойства водного раствора этиленгликоля
В таблице представлены следующие теплофизические и физические свойства этиленгликоля в виде водного раствора различной концентрации ζ: плотность ρ, температура замерзания tз, теплоемкость C, динамическая вязкость μ, кинематическая вязкость ν, теплопроводность λ, температуропроводность a, число Прандтля Pr этиленгликоля.
Физические свойства раствора этиленгликоля приведены в таблице в зависимости от температуры и его концентрации в растворе.
По данным таблицы видно, что с увеличением концентрации этиленгликоля в растворе его теплоемкость и теплопроводность уменьшаются, а температура замерзания раствора снижается при концентрации этиленгликоля до 66,3%. При дальнейшем увеличении концентрации этиленгликоля, температура замерзания раствора начинает повышаться.
В случаях применения раствора этиленгликоля в качестве антифриза в системе охлаждения автомобиля, снижение величин этих физических свойств этиленгликоля приведет к меньшему теплоотводу от двигателя. Таким образом, чем более концентрированный раствор этиленгликоля применяется в качестве охлаждающей жидкости, тем менее эффективно будет работать система охлаждения автомобиля в части отвода тепла от двигателя.
Физические свойства этиленгликоля даны в диапазоне температуры от минус 30 до 50°С и при концентрации этиленгликоля в растворе от 4,6 до 46,4 %.
Плотность и температура замерзания раствора этиленгликоля
В таблице даны значения плотности и температуры замерзания смеси технического этиленгликоля и воды в зависимости от концентрации. Следует отметить, что с увеличением содержания этиленгликоля в растворе, увеличивается плотность раствора. Температура замерзания раствора этиленгликоля при увеличении его концентрации в растворе снижается (до содержания этиленгликоля 66,3%), а затем начинает расти.
Таким образом, раствор этиленгликоля обладает свойством не замерзать до температуры -68°С при концентрации этиленгликоля в растворе 66,3%. Такие свойства раствора этиленгликоля в воде позволяют применять его в качестве антифриза во множестве систем.
Источники:
- Данилова Г.Н. и др. Сборник задач по процессам теплообмена в пищевой и холодильной промышленности. М.: «Пищевая промышленность» 1976.- 240 с.
- Лиханов В.А., Лопатин О.П. Технические жидкости: Учебное пособие. – Киров: Вятская ГСХА, 2005. – 43 с.
Температура замерзания этиленгликоля в зависимости от концентрации
| Раствор | Температура замерзания | Плотность при 20 ˚ С | Раствор | Температура замерзания | Плотность при 20 ˚ С |
| Пропиленгликоль 30% | -13 ˚ С | 1,023 | Этиленгликоль 30% | -15 ˚ С | 1,038 |
| Пропиленгликоль 35% | -20 ˚ С | 1,028 | Этиленгликоль 35% | 1,045 | |
| Пропиленгликоль 40% | -25 ˚ С | 1,032 | Этиленгликоль 40% | -25 ˚ С | 1,052 |
| Пропиленгликоль 45% | -30 ˚ С | 1,035 | Этиленгликоль 45% | -30 ˚ С | 1,058 |
| Пропиленгликоль 50% | -35 ˚ С | 1,038 | Этиленгликоль 50% | -35 ˚ С | 1,064 |
| Пропиленгликоль 55% | -45 ˚ С | 1,040 | Этиленгликоль 55% | -43 ˚ С | 1,071 |
| Пропиленгликоль 60% | -55 ˚ С | 1,042 | Этиленгликоль 60% | -50 ˚ С | 1,077 |
| Пропиленгликоль 65% | -60 ˚ С | 1,043 | Этиленгликоль 65% | -60 ˚ С | 1,083 |
| Пропиленгликоль 70% | -65 ˚ С | 1,044 | Этиленгликоль 70% | -70 ˚ С | 1,088 |
Из-за склонности растворов гликолей к переохлаждению фактическая температура замерзания может отличаться в пределах 2 ˚ С.
| Температура, ˚ С | Концентрация этиленгликоля ГОСТ 19774 высшего сорта в водном растворе (по массе) | |||||||||
| 10% | 20% | 30% | 40% | 50% | 60% | 70% | 80% | 90% | 100% | |
| -45 | 1,11 | 1,125 | 1,137 | |||||||
| -40 | 1,108 | 1,122 | 1,134 | |||||||
| -35 | 1,087 | 1,105 | 1,12 | 1,131 | ||||||
| -30 | 1,086 | 1,103 | 1,118 | 1,129 | ||||||
| -25 | 1,068 | 1,085 | 1,101 | 1,115 | 1,126 | |||||
| 1,067 | 1,083 | 1,098 | 1,112 | 1,123 | 1,133 | |||||
| -15 | 1,066 | 1,081 | 1,096 | 1,109 | 1,12 | 1,13 | 1,137 | |||
| -10 | 1,017 | 1,32 | 1,048 | 1,064 | 1,079 | 1,094 | 1,107 | 1,117 | 1,127 | 1,134 |
| -5 | 1,016 | 1,31 | 1,047 | 1,062 | 1,077 | 1,091 | 1,104 | 1,114 | 1,123 | 1,131 |
| 1,015 | 1,03 | 1,046 | 1,061 | 1,075 | 1,088 | 1,101 | 1,111 | 1,12 | 1,127 | |
| 5 | 1,014 | 1,029 | 1,044 | 1,059 | 1,073 | 1,085 | 1,097 | 1,108 | 1,116 | 1,124 |
| 10 | 1,013 | 1,027 | 1,042 | 1,056 | 1,07 | 1,083 | 1,094 | 1,105 | 1,113 | 1,120 |
| 15 | 1,012 | 1,026 | 1,041 | 1,054 | 1,067 | 1,08 | 1,091 | 1,102 | 1,10 | 1,117 |
| 20 | 1,011 | 1,024 | 1,038 | 1,052 | 1,064 | 1,077 | 1,088 | 1,098 | 1,106 | 1,113 |
| 25 | 1,009 | 1,022 | 1,036 | 1,05 | 1,061 | 1,074 | 1,084 | 1,094 | 1,102 | 1,11 |
| 30 | 1,021 | 1,034 | 1,047 | 1,058 | 1,071 | 1,081 | 1,091 | 1,099 | 1,106 | |
| 35 | 1,006 | 1,019 | 1,032 | 1,045 | 1,055 | 1,067 | 1,078 | 1,087 | 1,096 | 1,103 |
| 40 | 1,004 | 1,017 | 1,029 | 1,041 | 1,052 | 1,064 | 1,074 | 1,084 | 1,093 | 1,099 |
| 45 | 1,002 | 1,014 | 1,026 | 1,049 | 1,06 | 1,071 | 1,081 | 1,089 | 1,096 | |
| 50 | 0,999 | 1,012 | 1,023 | 1,035 | 1,046 | 1,057 | 1,067 | 1,077 | 1,085 | 1,093 |
| 55 | 0,996 | 1,009 | 1,021 | 1,032 | 1,043 | 1,054 | 1,064 | 1,073 | 1,082 | 1,089 |
| 60 | 0,994 | 1,006 | 1,018 | 1,029 | 1,04 | 1,051 | 1,06 | 1,069 | 1,078 | 1,085 |
| 65 | 0,991 | 1,003 | 1,014 | 1,026 | 1,037 | 1,047 | 1,057 | 1,065 | 1,074 | 1,081 |
| 70 | 0,988 | 1,0 | 1,011 | 1,023 | 1,034 | 1,044 | 1,053 | 1,062 | 1,07 | 1,078 |
| 75 | 0,986 | 0,997 | 1,008 | 1,019 | 1,029 | 1,04 | 1,05 | 1,058 | 1,066 | 1,074 |
| 80 | 0,983 | 0,994 | 1,005 | 1,016 | 1,026 | 1,036 | 1,046 | 1,054 | 1,063 | 1,07 |
| 85 | 0,979 | 0,99 | 1,001 | 1,012 | 1,022 | 1,032 | 1,042 | 1,05 | 1,059 | 1,067 |
| 90 | 0,976 | 0,987 | 0,997 | 1,009 | 1,018 | 1,028 | 1,038 | 1,046 | 1,055 | 1,063 |
| 95 | 0,973 | 0,983 | 0,993 | 1,005 | 1,014 | 1,024 | 1,034 | 1,043 | 1,051 | 1,059 |
| 100 | 0,969 | 0,98 | 0,99 | 1,0 | 1,01 | 1,02 | 1,03 | 1,04 | 1,047 | 1,055 |
Значения плотности растворов этиленгликоля в воде приведены в г/см 3 .
Смотрите также температуры замерзания водных растворов этиленгликоля при различных концентрациях.
Этиленгликоль ГОСТ 19774-78 высшего сорта с концентрацией основного вещества 99% поставляется ООО ТПК «ЭИ-ресурс» в бочках с массой нетто 244 кг или наливом в тару потребителя. У нас также можно купить диэтиленгликоль, пропиленгликоль и другие гликоли.
| Показатель и ед. измерения | Этиленгликоль | Диэтиленгликоль | Пропиленгликоль | Этилцеллозольв |
| ГОСТ | ГОСТ 19710-78 | ГОСТ 10136-77 | Нидерланды, сходен с ГОСТ 19710-78 | ГОСТ 8313-88 |
| Марка или сорт поставляемого продукта | Высший сорт | Марка А | Industrial, USP | Высший сорт |
| Содержание | 99,9 | 99,5 | 99,9 | 99,8 |
| Внешний вид | вязкая жидкость | вязкая жидкость | вязкая жидкость | легкоподвижная маслянистая жидкость |
| Формула | С2Н6О2 | С4Н10О3 | С3Н8О2 | С3Н10О2 |
| Плотность при 20 ˚ С, г/см 3 | 1,113 | 1,116 | 1,036 | 0,93 |
| Вязкость при 20 ˚ С, МПа · с | 20,9 | 35,6 | 56,1 | 2,1 |
| Температура кипения при атмосферном давлении, ˚ С | 197 | 245 | 188 | 136 |
| Температура замерзания, ˚ С | -13 | -8 | -60 | -70 |
| Молекулярная масса | 62,1 | 106,1 | 76,1 | |
| Давление насыщенных паров при 20 ˚ С, Па | 8 | 1,1 | 11 | |
| Температура вспышки, ˚ С | 115 | 135 | 102 | |
| Температура воспламенения, ˚ С | 118 | 143 | 104 | |
| Температура самовоспламенения, ˚ С | 380 | 345 | 420 |
Все гликоли и этилцеллозольв в исходном виде являются бесцветными, прозрачными жидкостями, однако часто окрашиваются при хранении и эксплуатации примесями, что обычно не ухудшает их эксплуатационных характеристик.
| Температура, ˚ С | Концентрация пропиленгликоля в водном растворе % (массовых) | |||||||||
| 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | |
| -30 | 1,073 | |||||||||
| -25 | 1,069 | |||||||||
| -20 | 1,055 | 1,064 | 1,068 | 1,065 | ||||||
| -15 | 1,024 | 1,052 | 1,061 | 1,065 | 1,062 | |||||
| -10 | 1,022 | 1,038 | 1,050 | 1,058 | 1,062 | 1,059 | ||||
| -5 | 1,010 | 1,020 | 1,035 | 1,047 | 1,055 | 1,059 | 1,055 | |||
| 1,009 | 1,020 | 1,033 | 1,044 | 1,052 | 1,056 | 1,051 | ||||
| 5 | 1,008 | 1,019 | 1,031 | 1,041 | 1,048 | 1,052 | 1,055 | 1,055 | 1,052 | 1,047 |
| 10 | 1,008 | 1,018 | 1,030 | 1,038 | 1,044 | 1,049 | 1,051 | 1,051 | 1,049 | 1,044 |
| 15 | 1,008 | 1,017 | 1,026 | 1,034 | 1,042 | 1,046 | 1,048 | 1,048 | 1,045 | 1,040 |
| 20 | 1,006 | 1,015 | 1,023 | 1,032 | 1,039 | 1,042 | 1,044 | 1,044 | 1,041 | 1,037 |
| 25 | 1,004 | 1,012 | 1,020 | 1,027 | 1,032 | 1,037 | 1,040 | 1,040 | 1,037 | 1,033 |
Плотность приведена в г / см 3 с точностью до 1 · 10 -3 г / см 3 .


Пишу с опозданием, зима уже на излете, хоть и не сдается до последнего. Но эта тема актуальна для лета не меньше, чем для зимы. Поскольку антифриз не просто должен не замерзать зимой, но еще и должен эффективно отводить тепло летом. И насколько он будет соответствовать этим свойствам зависит от концентрации гликоля в антифризе.
Еще перед зимой заменил антифриз в машине, заливал оригинальный концентрат от BMW арт. 83512355290. Производитель рекомендует разбавлять его в пропорции 50% на 50% с дистиллированной водой для получения температуры замерзания -40 С. Хотя в этой рекомендации есть небольшая неточность, т.к. 50% раствор этиленгликоля замерзает примерно при -38 С. Именно из раствора этиленгликоля и состоят в основном антифризы G11 и G12




Как видно из графика, чем выше концентрация, тем ниже коэффициент теплопроводности и тем менее эффективно будет отводится тепло от двигателя таким раствором. Кроме того любопытно, что просто вода имеет коэффициент теплопроводности значительно выше, чем раствор гликоля.
Поэтому концентрация этиленгликоля крайне важна.
Вот нам с одним коллегой по работе стало любопытно, что же у нас там залито в радиаторах. Мне было интересно проверить, что там мне намешали в сервисе при замене. И мы решили провести собственные замеры концентрации. Итак, как же ее замерить? Самый простой и дешевый способ -это замерить плотность ареометром, и по плотности получить табличное значение концентрации. Ареометры стоят недорого и доступны в любом автомагазине, но точность этого метода оставляет желать лучшего. Поэтому мы решили прибегнуть к измерению концентрации через коэффициент преломления (рефракцию) с помощью рефрактометра.
Заказали вот такой вот рефрактометр.


Кроме антифризов, он пригоден еще и для мочевины (AdBlue) и для электролита АКБ. Есть еще шкала для «незамерзайки», но в нашей стране она не очень применима. И еще есть шкала SRF1, но что это такое, так и осталось для нас загадкой. С такой аббревиатурой встречается только тормозная жидкость нового типа.
Набрали образцов жидкостей и приступили к измерениям.


В комплекте есть пипетка, с помощью которой раствор наносится на рабочую поверхность рефрактометра и прижимается прижимным стеклышком. Получаем вот такую картину.


Как видно, температура замерзания около -38 С, что как раз соответствует концентрации 50%. Можно выдохнуть и быть уверенным в правильности концентрации залитого антифриза!

 Важнейшим теплофизическим параметром водного раствора этиленгликоля является зависимость температуры замерзания раствора от его концентрации. Эта зависимость носит нелинейный характер и температура замерзания (кристаллизации) водного раствора этиленгликоля достигает своего минимума в -65°C при концентрации 65%, затем при дальнейшем повышении концентрации до 98% температура замерзания повышается до -13°C. Концентрация, количество этиленгликоля, содержащегося в теплоносителе, формирует в основном и цену самого теплоносителя. Поэтому не целесообразно и экономически не выгодно производство и применение водных растворов этиленгликоля с концентрацией выше 70%.
Важнейшим теплофизическим параметром водного раствора этиленгликоля является зависимость температуры замерзания раствора от его концентрации. Эта зависимость носит нелинейный характер и температура замерзания (кристаллизации) водного раствора этиленгликоля достигает своего минимума в -65°C при концентрации 65%, затем при дальнейшем повышении концентрации до 98% температура замерзания повышается до -13°C. Концентрация, количество этиленгликоля, содержащегося в теплоносителе, формирует в основном и цену самого теплоносителя. Поэтому не целесообразно и экономически не выгодно производство и применение водных растворов этиленгликоля с концентрацией выше 70%.Нелинейный характер зависимости температуры кристаллизации водного раствора этиленгликоля от его концентрации представлены в табл. №1 в виде двух функциональных зависимостей: 1) значения величины плотности водного раствора этиленгликоля в зависимости от его концентрации при температуре 20°C и 2) зависимость температуры кристаллизации водного раствора от концентрациии этиленгликоля.
Табл. №1. Влияние концентрации этиленгликоля на температуру замерзания (начала кристаллизации) водного раствора этиленгликоля. Значения (величины) плотности раствора при температуре 20°C.
| Концентрация этиленгликоля, % | Температура замерзания (начала кристаллизации), t°C | Плотность при 20 °C |
| 30% | -15 °C | 1,038 |
| 35% | -20 °C | 1,045 |
| 40% | -25 °C | 1,052 |
| 45% | -30 °C | 1,058 |
| 50% | -35 °C | 1,064 |
| 54% | -40 °C | 1,071 |
| 60% | -50 °C | 1,077 |
| 65% | -65 °C | 1,083 |
| 70% | -60 °C | 1,088 |
Хранение водного раствора этиленгликоля
Раствор этиленгликоля токсичен и это действие зависит от ряда обстоятельств, таких, как индивидуальная чувствительность организма, количества вещества, попавшего в организм, состояния нервной системы и др.
Раствор этиленгликоля хранится в не отапливаемых складских помещениях, в герметичных стальных и алюминиевых емкостях с антикоррозионным покрытием внутренних поверхностей. Емкости хранятся в вертикальном положении. Срок хранения раствора этиленгликоля в соответствующей таре составляет 5 лет со дня изготовления с возможностью продления срока при условии соответствующих показателей качества.
Этиленгликоль, моноэтиленгликоль, МЭГ.
Описание продукта (химическая формула, назначение):
— Формула: HO-Ch3-Ch3-OH
— Молекулярная масса: 62,07
ГОСТ 19710-83 Этиленгликоль.
Этиленгликоль получают при гидратации окиси этилена.
1. Технические характеристики.
№ Наименование показателя Норма высший сорт 1-й сорт
ОКП 24 2212 0120 ОКП 24 2212 0130
1. Массовая доля этиленгликоля, %, не менее 99,8 99,5
2. Массовая доля диэтиленгликоля, %, не более 0,05 1,0
3. Цвет, единицы Хазена, не более
— В обычном состоянии 5 20
— После кипячения с соляной кислотой 20 не нормируется
4. Массовая доля остатка после прокаливания, %, не более 0,001 0,002
5. Массовая доля железа (Fe), %, не более 0,00001 0,0005
6. Массовая доля воды, %, не более 0,1 0,5
7. Массовая доля кислот в пересчете на уксусную кислоту, %,
не более 0,0006 0,005
8. Показатель преломления при 20 С 1,431 — 1,432 1,430 — 1,432
Настоящий стандарт распространяется на этиленгликоль, получаемый гидратацией окиси этилена, и устанавливает требования к этиленгликолю, изготовленному для нужд народного хозяйства и экспорта.
Этиленгликоль применяют в производстве синтетических волокон, смол, растворителей, низкозамерзающих и гидравлических жидкостей, косметике и для других целей.
По внешнему виду этиленгликоль представляет собой прозрачную жидкость.
Моноэтиленгликоль — это двухатомный спирт, бесцветная, вязкая, сладковатая на вкус жидкость, с температурой кипения 197 oС, плотностью при 20 oС = 1,112-1,113 г/см3, температурой начала замерзания минус 12-13 oС.
Этиленгликоль — основа охлаждающих жидкостей обладает уникальной возможностью не замерзать при пониженных температурах.
Исключительно важным свойством этиленгликоля является его способность понижать температуру замерзания водных растворов. При определенном соотношении системы «вода — этиленгликоль» можно получить жидкость с необходимой температурой замерзания от минус 1 до минус 70 oС. Водные растворы этиленгликоля не расширяются при замерзании и не образуют сплошной твердой массы, а превращаются в кашицеобразную рыхлую массу, объем которой больше первоначального только на 0,25%-0,30%.
Чтобы разбавленный водой этиленгликоль стал охлаждающей автожидкостью, в него необходимо добавить еще около 7-8, а то и больше компонентов, и отсутствие какого-либо из них может не только существенно снизить качество антифриза, но и просто стать опасной для автомобильных систем охлаждения.
2. Плотность этиленгликоля в зависимости от температуры
оС кг/дм3 оС кг/дм3 оС кг/дм3
-10 1,1352 12 1,1194 34 1,1042
-9 1,1346 13 1,1188 35 1,1036
-8 1,134 14 1,1182 36 1,103
-7 1,1334 15 1,1176 37 1,1022
-6 1,1328 16 1,117 38 1,1014
-5 1,1322 17 1,1162 39 1,1006
-4 1,1316 18 1,1154 40 1,0998
-3 1,131 19 1,1146 41 1,099
-2 1,1304 20 1,1138 42 1,0984
-1 1,1298 21 1,113 43 1,0978
0 1,129 22 1,1124 44 1,0972
1 1,127 23 1,1118 45 1,0966
2 1,1266 24 1,1112 46 1,096
3 1,1261 25 1,1106 47 1,0954
4 1,1257 26 1,11 48 1,0948
5 1,1253 27 1,1092 49 1,0942
6 1,1249 28 1,1084 50 1,0936
7 1,1245 29 1,1076 51 1,093
8 1,124 30 1,1068 52 1,092
9 1,1227 31 1,106 53 1,091
10 1,1214 32 1,1054 54 1,09
11 1,12 33 1,1048 55 1,089
Температура замерзания водно-гликолевой смеси
Температура замерзания водно-гликолевого раствора
3. Сравнительная характеристика физико-химических свойств воды и моноэтиленгликоля
Показатель Вода МЭГ
Молярная масса 18,01 62,07
Плотность при 20оС, кг/м3 998,2 1113
Температура замерзания, оС 0 -12
Температуры кипения при 0,1 МПа, оС 100 197,7
Теплоемкость при 20оС, кДж/(кг*оС) 4,184 2,422
Коэффициент теплопроводности,
кДж/(ч*м*оС) 2,179 0,955
Вязкость при 20оС, мм2/с 1,0 19-20
Теплота испарения, кДж/кг 2,258 0,800
Коэффициент объемного
расширения (0-100оС) 0,00046 0,00062
4. Свойства водных растворов этиленгликоля
Концентрация этиленгликоля, Плотность кг/дм3, Температура замерзания, оС
% по массе при 20оС
26,4 1,0340 -10
36,4 1,0506 -20
45,6 1,0627 -30
52,6 1,0713 -40
58,0 1,0780 -50
63,1 1,0833 -60
66,0 1,0848 -65
66,7 1,0856 -73
72,1 1,0923 -60
78,4 1,0983 -50
Этиленгликоль в очищенном виде – это прозрачная бесцветная жидкость маслянистой консистенции без запаха.
Этиленгликоль применяют в качестве теплоносителя в системах нагрева и отопления, используют в системах охлаждения как холодоноситель в производстве антифризов, тосолов, гидравлических, тормозных жидкостей для автомобилей. Еще несколько сфер использования этиленгликоля: производство смол, синтетических волокон, растворителей, полиуретанов, душистых и взрывчатых веществ, кожевенная промышленность и фармакология.
Особо отметим, что этиленгликоль как низкозамерзающая жидкость (антифриз) заменяет воду из-за низкой температуры замерзания и более высокой температуры кипения. Этиленгликоль т.о., применяется, как охлаждающая жидкость в ДВС, антиобледенитель в авиации, хладоноситель в системах охлаждения.
Вернуться к списку…
Водные растворы Этиленгликоля
Водные растворы этиленгликоля с концентрацией 30 % и выше замерзают при значительно более низкой температуре, чем чистый этиленгликоль. Наиболее распространенные антифризы представляют собой водные растворы этиленгликоля с антикоррозийными прибавками. Коррозия водных растворов этиленгликоля может быть снижена путем добавления триэтаноламинофосфата.
Для улучшения теплофизических свойств
Для улучшения теплофизических свойств водного раствора этиленгликоля (теплоносителя, антифриза, незамерзающей жидкости) применяемый пакет присадок насчитывает около десятка веществ, предназначенных для снижения коррозионных и окислительных свойств раствора, его пенообразования, предотвращения образования накипи и удаления уже существующей накипи, а также для стабилизации теплофизических характеристик теплоносителя (Характеристики качества растворов этиленгликоля должны соответствовать требованиям ГОСТ 28084-89 «Незамерзающие жидкости охлаждающие» и ТУ, разработанных на его основе).
Большинство концентрированных теплоносителей представляют собой раствор, состоящий из 60%-65% этиленгликоля, 30%-35% воды и 3%-4% активных присадок.
Такие процентные соотношения этиленгликоля, воды и ингибиторов позволяют получить наилучшие теплофизические характеристики водного раствора, как эффективного теплоносителя с максимальной минусовой температурой начала кристаллизации -70°С.
Водные растворы этиленгликоля с меньшей температурой замерзания производятся с применением меньшей концентрации этиленгликоля и массовая доля присадок (ингибиторов) остается при этом практически неизменной.
Таблица плотности и температуры замерзания (начала кристаллизации) водных растворов этиленгликоля
| Концентрация этиленгликоля,% | Плотность раствора, г/см3 при 20оС | Температура замерзания, оС | Концентрация этиленгликоля,% | Плотность раствора, г/см3 при 20оС | Температура замерзания, оС |
| 26,4 | 1,0340 | -10 | 65,3 | 1,0855 | -65 |
| 27,2 | 1,0376 | -12 | 65,6 | 1,0860 | -66 |
| 29,6 | 1,0410 | -14 | 66,0 | 1,0863 | -67 |
| 32,0 | 1,0443 | -16 | 66,3 | 1,0866 | -68 |
| 34,2 | 1,0480 | -18 | 68,5 | 1,0888 | -66 |
| 36,4 | 1,0506 | -20 | 69,6 | 1,0900 | -64 |
| 38,4 | 1,0533 | -22 | 70,8 | 1,0910 | -62 |
| 40,4 | 1,0560 | -24 | 72,1 | 1,0923 | -60 |
| 42,2 | 1,0586 | -26 | 73,3 | 1,0937 | -58 |
| 44,0 | 1,0606 | -28 | 74,5 | 1,0947 | -56 |
| 45,6 | 1,0627 | -30 | 75,8 | 1,0960 | -54 |
| 47,0 | 1,0643 | -32 | 77,0 | 1,0973 | -52 |
| 48,2 | 1,0663 | -34 | 78,4 | 1,0983 | -50 |
| 49,6 | 1,0680 | -36 | 79,6 | 1,0997 | -48 |
| 51,0 | 1,0696 | -38 | 81,2 | 1,1007 | -46 |
| 52,6 | 1,0713 | -40 | 82,5 | 1,1023 | -44 |
| 53,6 | 1,0726 | -42 | 83,9 | 1,1033 | -42 |
| 54,6 | 1,0740 | -44 | 85,4 | 1,1043 | -40 |
| 55,6 | 1,0753 | -46 | 86,9 | 1,1054 | -38 |
| 56,8 | 1,0766 | -48 | 88,4 | 1,0660 | -36 |
| 58,0 | 1,0780 | -50 | 90,0 | 1,1077 | -35 |
| 59,1 | 1,0790 | -52 | 91,5 | 1,1987 | -34 |
| 60,2 | 1,0803 | -54 | 93,0 | 1,1096 | -33 |
| 61,2 | 1,0813 | -56 | 94,4 | 1,1103 | -32 |
| 62,2 | 1,0823 | -58 | 95,0 | 1,1105 | -28 |
| 63,1 | 1,0833 | -60 | 95,5 | 1,1107 | -27 |
| 64,0 | 1,0843 | -62 | 96,5 | 1,1110 | -24 |
| 64,8 | 1,0850 | -64 | 97,0 | 1,1116 | -22 |
Справочные материалы
Измерение температуры кристаллизации ТН
Этот вопрос особенно важен для покупателей теплоносителя — антифриза, которые желают убедиться, что купленный товар точно соответствует заявленной температуре начала кристаллизации. Также он важен для производителей антифриза при проведении выходного контроля.
Поскольку процесс замерзания антифриза происходит в достаточно большом интервале температур, измеряют обычно температуру начала кристаллизации, то есть момент, когда в образце жидкости появляются первые кристаллы в виде помутнения или «облачка». Этот показатель можно измерить достаточно точно. Для измерения температуры начала кристаллизации существует общепринятая лабораторная методика, в России это п. 4.3.3 ГОСТ 28084-89, за рубежом — ASTM D1177. Обе методики предполагают охлаждение образца жидкости до ее кристаллизации или, проще говоря, до «заморозки» жидким азотом.
Существует также множество лабораторно-бытовых приборов для измерения температуры начала кристаллизации в «полевых» условиях. При использовании таких приборов антифриз не замораживается до появления кристаллов, а измеряются другие характеристики — плотность или показатель преломления, которые связаны с концентрацией этиленгликоля в растворе и соответственно с температурой замерзания.
Однако следует учесть ряд моментов при применении таких приборов во избежание ошибок, неточностей и неправильных выводов.
Первый тип таких лабораторно-бытовых приборов — это погружной ареометр (поплавок). Он опускается в жидкость, и по глубине его погружения можно судить о плотности, следовательно, и о температуре замерзания данной жидкости. Иногда измерительную шкалу таких ареометров (их также называют ареометр-гидрометр) градуируют не как обычно в граммах на кубический сантиметр, а сразу в градусах Цельсия, или в процентах содержания этиленгликоля в растворе. Типичным представителем этого класса приборов является «Ареометр-гидрометр АЭГ /тосол, антифриз/», который выпускается нашей промышленностью. Следует иметь в виду, что каждый такой ареометр-гидрометр настроен на определенную жидкость, например на «Тосол АМ» или на водно-этиленгликолевый раствор, и при измерении другого антифриза он будет давать существенную ошибку.
При пользовании ареометром-гидрометром следует учитывать четыре обстоятельства. Во-первых, этот прибор реально измеряет плотность жидкости, а не другие ее характеристики. Поэтому замер, сделанный ареометром-гидрометром, может служить только индикатором, оценкой температуры замерзания, но не квалификационным тестом. К примеру, вы можете насыпать в антифриз соли, в результате чего его плотность увеличится, и ареометр-гидрометр, покажет отличную «низкую температуру замерзания», которая, правда, не будет совпадать с истинной температурой замерзания.
Во-вторых, все антифризы (и тосолы) содержат в своем составе, кроме воды и этиленгликоля, пакеты присадок, которые отличаются друг от друга по количеству и по плотности. Поэтому различные антифризы при разбавлении водой имеют различные зависимости плотности от температуры замерзания, хотя и похожие друг на друга.
В-третьих, при измерениях ареометром-гидрометром следует строго соблюдать заданную температуру измеряемой жидкости. Известно, что все тела при нагревании расширяются, в том числе антифриз. Поэтому один и тот же антифриз будет иметь разную плотность на улице и в теплом помещении. Соответственно показания ареометра-гидрометра будут разными: на улице антифриз окажется «хорошим», а в помещении этот же антифриз уже станет «плохим». Для подавляющего большинства таких приборов предполагается проведение измерения при температуре жидкости строго плюс 20°С.
В-четвертых, ареометр-гигрометр не способен определять температуру кристаллизации концентрированных теплоносителей-антифризов. Лучше это сделать после разведения согласно инструкции по применению. Например, при разбавлении теплоносителя «Теплый дом-65» водой 1:1, температура должна быть в пределах -17ºС (некоторые производители говорят, что -20 ºС. Однако простой расчет: 65% гликоля(-65 ºС) : 2=32,5%, что соответствует -17 ºС, для -20 надо 36% гликоля!)
Наилучший способ оценки температуры замерзания антифриза в «полевых» условиях связан с применением обычного ареометра в сочетании с термометром. Вы наполняете прозрачную емкость, например, обрезанную пластиковую бутылку антифризом, опускаете в жидкость термометр, доводите жидкость до температуры плюс 20°С, обливая емкость снаружи горячей или холодной водой и постоянно помешивая, и измеряете плотность жидкости ареометром. Желательно применять лабораторный ареометр с точностью деления 0,001 г/куб см. Затем определяете температуру начала кристаллизации антифриза по таблице или графику зависимости этой температуры от плотности, составленному для данной марки антифриза. Точность такого замера может составить +/- 2°С, но не выше.
Второй тип лабораторно-бытовых приборов — это рефрактометр. Фактически этот прибор измеряет оптическую характеристику антифриза — показатель преломления, который тоже связан со степенью разведения антифриза водой и его температурой начала кристаллизации. Поскольку рефрактометр более точный (прецизионный) прибор, чем ареометр, точность определения температуры начала кристаллизации антифриза с его помощью может составить уже +/- 1°С. Типичными представителями рефрактометров являются лабораторный «Рефрактометр ИРФ 454Б2М» и карманные ATAGO «Master BR» или «Refraktometr VBC4T».
При пользовании рефрактометром следует соблюдать правила и предосторожности, описанные выше. Измерения проводить при температуре жидкости строго плюс 20°С. Пользоваться таблицей перевода показателя преломления в температуру начала кристаллизации для данной марки антифриза. Если у карманного рефрактометра измерительная шкала уже задана в градусах Цельсия, иметь в виду, что эта шкала адаптирована к какому-то конкретному антифризу, скорее всего к смеси этиленгликоля и воды. Такой прибор не способен измерять концентрированные теплоносители-антифризы. Перед измерением их надо развести, как описано выше.
| | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Рабочие среды / / Антифризы. Рассолы — антифризы. Рассолы. / / Как разбавлять антифриз для систем отопления и центрального кондиционирования. Температура замерзания водных растворов этиленгликоля и пропиленгликоля. Концентрация по массе. Поделиться:
| |||||||
Этиленгликоль — Википедия
Материал из Википедии — свободной энциклопедии
| Этиленгликоль | |||
|---|---|---|---|
| |||
| Систематическое наименование | этандиол-1,2 | ||
| Традиционные названия | гликоль, этиленгликоль, 1,2-диоксиэтан, 1,2-этандиол | ||
| Хим. формула | C2H6O2 | ||
| Рац. формула | C2H4(OH)2 | ||
| Состояние | бесцветная жидкость | ||
| Молярная масса | 62,068 г/моль | ||
| Плотность | 1,113 г/см³ | ||
| Температура | |||
| • плавления | −12,9 °C | ||
| • кипения | 197,3 °C | ||
| • вспышки | 111 °C | ||
| Пределы взрываемости | 3,2 ± 0,1 об.%[1] | ||
| Давление пара | 0,06 ± 0,01 мм рт.ст.[1] | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 15,1 ± 0,1[2] | ||
| Показатель преломления | 1,4318 | ||
| Рег. номер CAS | 107-21-1 | ||
| PubChem | 174 | ||
| Рег. номер EINECS | 203-473-3 | ||
| SMILES | |||
| InChI | |||
| RTECS | KW2975000 | ||
| ChEBI | 30742 | ||
| ChemSpider | 13835235 | ||
| Предельная концентрация | 5 мг/м3 | ||
| ЛД50 | 4700 мг/кг (крысы, перорально) | ||
| Токсичность | ядовит | ||
| Фразы риска (R) | R22 | ||
| Краткие характер. опасности (H) | |||
| Меры предостор. (P) | P264, P270, P301+P312, P330, P501 | ||
| Пиктограммы СГС |  | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Этиленглико́ль (гликоль, 1,2-диоксиэтан, этандиол-1,2), HO—CH2—CH2—OH — кислородсодержащее органическое соединение, двухатомный спирт, простейший представитель полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов в организм человека может привести к необратимым изменениям в организме и к летальному исходу.[3]
Этиленгликоль впервые был получен в 1859 году французским химиком Вюрцем из диацетата этиленгликоля омылением гидроксидом калия и в 1860-м гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Саут Чарлстона (Западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» (англ.). К 1929 году этиленгликоль использовался практически всеми производителями динамита.
В 1937 компания Carbide начала первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190‒200 °С или при 1 атм и 50‒100 °С в присутствии 0,1‒0,5% серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются диэтиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60% его потребления. Смесь 60% этиленгликоля и 40% воды замерзает при −49 °С. Коррозионно активен, поэтому применяется с ингибиторами коррозии;
- Используется как теплоноситель с содержанием не более 50% в системах отопления (частные дома в основном)
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
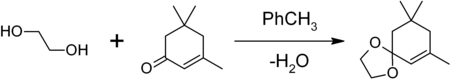
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана[4] или комплекса диметилсульфат-ДМФА[5] 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- Как компонент противоводокристаллизационной жидкости «И».
- Для поглощения воды, для предотвращения образования гидрата метана (ингибитор гидратообразования), который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенерируют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
Этиленгликоль также применяется:
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8‒6,4% (по объему).
Этиленгликоль умеренно токсичен[6][7]. По степени воздействия на организм относится к веществам 3-го класса опасности.
Летальная доза при однократном пероральном употреблении составляет 100‒300 мл этиленгликоля (1,5‒5 мл/кг массы тела)[8]. Имеет относительно низкую летучесть при нормальной температуре, пары обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании. Определённую опасность представляют туманы, однако при их вдыхании об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол[9].
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, которая вызывает повреждения почечной ткани. Этиленгликоль и его метаболиты выводятся из организма с мочой[10].
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0272.html
- ↑ P. Ballinger, Long F. A. Acid Ionization Constants of Alcohols. II. Acidities of Some Substituted Methanols and Related Compounds 1,2 // J. Am. Chem. Soc. / P. J. Stang — American Chemical Society, 1960. — Vol. 82, Iss. 4. — P. 795–798. — ISSN 0002-7863; 1520-5126; 1943-2984 — doi:10.1021/JA01489A008
- ↑ Monograph on the Potential Human Reproductive and Developmental Effects of Ethylene Glycol (неопр.) (недоступная ссылка). Дата обращения 8 января 2009. Архивировано 13 января 2009 года.
- ↑ SYNTHESIS 1983, No 3,pp 203—205
- ↑ Liebigs Annalen Chemie 1979, pp 1362—1369
- ↑ CDC — The Emergency Response Safety and Health Database: Systemic Agent: ETHYLENE GLYCOL — NIOSH
- ↑ Архивированная копия (неопр.) (недоступная ссылка). Дата обращения 24 января 2018. Архивировано 15 октября 2018 года.
- ↑ Е.Ю.Бонитенко и др. Отравления этиленгликолем и его эфирами – СПб.: «Изд-во НИИХ СПбГУ», 2003 г. — Medline.Ru
- ↑ Flomenbaum, Goldfrank et al. Goldfrank’s Toxicologic Emergencies. 8th Edition. — McGraw Hill, 2006. — С. 1460, 1465. — 2170 с. — ISBN 0071437630.
- ↑ В. Ф. Крамаренко. Токсикологическая химия. — К.: Выща шк., 1989. — 447 с. — 6 000 экз. — ISBN 5-11-000148-0.

 (
(