Ученые разработали экономичный способ получения водорода
Известно, что водород является одним из перспективных видов экологически чистого топлива, источник которого неисчерпаем в буквальном смысле этого слова. Однако, все процессы получения водорода, используемые в химической промышленности на сегодняшний день, крайне дорогостоящи и имеют отрицательный энергетический баланс, что делает экономически необоснованным начало широкого использования водородного топлива.
Воспользуйтесь нашими услугами
Однако, в ближайшем времени данная ситуация может измениться благодаря работе ученых из Королевского Технологического института KTH (KTH Royal Institute of Technology) в Стокгольме. Эти ученые разработали новый, стабильный, высокоэффективный и, самое главное, недорогой способ получения водорода путем электрохимического расщепления воды.
Процесс расщепления воды под воздействием электрического тока используется уже очень давно для получения водорода. Но катализаторы, участвующие в этом процессе, обычно изготавливаются на базе драгоценных или редкоземельных металлов, что делает такой процесс весьма и весьма дорогим. Именно на катализаторах и сосредоточилась исследовательская группа, возглавляемая профессором Ликэнгом Суном (Licheng Sun), за плечами которой уже имеется опыт разработки молекулярных катализаторов для процесса фотохимического расщепления воды, эффективность которых приближается к эффективности естественного фотосинтеза.
Новые катализаторы, разработанные исследовательской группой, изготовлены на базе достаточно распространенных на Земле материалов. Основой этого катализатора является монослойная двойная гидроокись никеля и ванадия, толщина слоя которого составляет менее одного нанометра. Такой каталитический монослой никеля и ванадия по многим параметрам выигрывает у других катализаторов, изготовленных из недрагоценных металлов, по эффективности он уже может составить конкуренцию с катализаторами на базе окиси иридия (IrO2) или окиси рутения (RuO2).
Использование монослойного катализатора позволяет не только увеличить активную поверхность электродов установки электролиза. Его использование увеличивает эффективность передачи электронов из электронов в электролит и наоборот, что также сказывается на увеличении эффективности процесса в целом.
“Основной трудностью, с которой мы столкнулись, было введение металлического ванадия в гидроокись никеля. Но потраченные усилия не пропали даром, и полученные результаты превзошли все наши ожидания” – рассказывает Ки Фэн (Ke Fan), один из исследователей, – “Полученная эффективность расщепления воды при участи нового катализатора уже позволяет использовать его для производства гидролизных ячеек нового типа, потенциал которых способен произвести революцию в технологиях получения водорода”.
Воспользуйтесь нашими услугами
Понравилась статья? Тогда поддержите нас, поделитесь с друзьями и заглядывайте по рекламным ссылкам!
integral-russia.ru
Получение водорода. Установки получения (производства) водорода.
Общее описание
- Генератор водорода
- Установка оборудована 2 пакетами элементов для производства водорода 30 нм³/ч
- Контейнер модернизирован и подготовлен для увеличения производительности в будущем до 45 нм³/ч. Так же если в будущем потребуется дополнительно увеличить мощность, то контейнер рассчитан на увеличение до 60 нм³/ч.
- Модуль хранения объемом 50 м³ по воде для хранения 450 нм³ водорода при 10 бар.
Предложенная нами система включает стандартные встроенные системы безопасности, стандартное заводское приемочное испытание и комплект технической документации.
Услуги на месте включают: пуск системы, ввод в эксплуатацию и обучение на месте. Строительные работы и подготовка площадки, выполняемые на месте, осуществляются заказчиком в соответствии с требованиями.
Энергоисточники (вода, электричество, азот, воздух КИП,…) должны быть доступны на месте.
Характеристики электролизера:
- Полностью автоматическая работа
- Полный контроль получения водорода
- Производство под давлением (10 бар изб.) без установки компрессора
- Высокая эффективность и надежность
- Очень низкие затраты на техническое обслуживание (ограниченное число подвижных деталей, без насоса для электролита)
- Водород не содержит углерода – без вредных выбросов
- Производственный процесс сертифицирован по ISO 9001, 14001
- Услуги по пуску и пост-продажному обслуживанию
Введение
Установка производства водорода в контейнерном исполнении для установки снаружи представляет собой комплексную установку производства водорода с производительностью по водороду 60 нм³/ч при чистоте 99,998% и давлении 10 бар (изб.)
Разработан модифицированный ISO контейнер повышенной вместимости для размещения генератора водорода и всего его питающего оборудования.
Ввод оборудования для наружного размещения в эксплуатацию на площадке заказчика тем самым значительно облегчен по сравнению с установкой в существующее помещение генератора на базе скида.
Надежность
Используя принцип внедрения технологического уровня эксплуатационной безопасности оборудования каждая установка помимо прочего обладает следующими характеристиками:
- минимальное присутствие газа в системе
- определение минимального давления для предотвращения попадания воздуха
- система непрерывного мониторинга/обнаружения водорода в атмосфере
- система защитной вентиляции зона II (только с кожухом или корпусом (каркасом) для наружного размещения)
- надежная логическая схема для всех параметров
- Система бесперебойного питания, обеспечивающая безопасное отключение в случае аварийного отключения питания
- Система постоянного мониторинга, чистота производства О2 газа
- Системы множественного / параллельного управления
- Многократное резервирование параметров, которые являются критичными в рамках безопасности системы
Автоматизация
Надежность – это одно из наиболее значимых требований для наших заказчиков. Установка разработана для полностью непрерывной эксплуатации с минимальной потребностью в присутствии оператора, обеспечивая константный поток водорода.
- Система контроля давления: Человеко-машинный интерфейс на панели управления позволяет операторы выбрать требуемое давление газа (между 8 и 10 бар изб.). Установка автоматически регулирует свою производительность с тем, чтобы обеспечить установленное давление.
- Автоматизация охлаждения: охлаждающая вода поступает в теплообменники через клапан, регулируемый ПЛК. При повышении температуры клапан открывается, тем самым подавая большее количество охлаждающей воды в контур. В результате этого – стабильная производственная температура.
- Автоматическая продувка азотом: следуя принципам системы, продувка азотом требуется перед запуском установки при внутреннем давлении ниже 15 кПа. Процесс продувки регулируется ПЛК системы путем активации клапана в последовательном процессе.
- Удаленный I/O: используя современное соединение PROFIBUS, мы значительно уменьшили количество соединительных кабелей и соответственно время, необходимое на установку. Внедрение прокола в комбинации с безопасным ПЛК и безопасным I/O позволяет системе полностью соответствовать самым строгим актуальным нормам и стандартам безопасности. ПЛК автоматически диагностирует любые ошибки передачи данных, не только делая систему безопаснее, но также сокращая время и силы на устранения неполадок.
Объем поставки
Сенсорный экран с человеко-машинным интерфейсом (HMI)
Экран HMI расположен на панели управления и позволяет оператору контролировать и эксплуатировать электролизер либо с экрана, либо с удаленного соединения, через защищенное соединение VPN. Система мониторинга включает в себя запись данных на компактную флэш карту. Она также позволяет нашим техническим специалистам подключаться к электролизеру, для диагностики и исправления случаев неисправностей и тревожной сигнализации при необходимости.
Исполнение контейнера
ISO 40’ футовый контейнер спроектирован и модифицирован для размещения водородной установки 60 нм³/ч и включает:
- изолированные стенки и перекрытия
- пол из металлических листов
- запираемые двери во внешних стенках
- Освещение во всех отсеках
- Все устройства полностью оснащены и установлены на место вкл. трубную обвязку и кабели, что значительно сокращает время и затраты на установку / межсоединения на месте.
- Два вытяжных вентилятора, которые вытягивают воздух через технологическое помещение из помещения общего назначения. Первый обеспечивает минимальный поток и работает постоянно. Поток проверяется между помещением общего назначения и технологическим помещением и подается аварийный сигнал, если минимум не достигнут.
Второй вентилятор активируется, когда температура окружающего воздуха в технологическом помещении находится вне пределов спецификации или когда обнаружен водород.

Ключевым компонентов электролизного скида является пакет биполярных ячеек для электролиза воды под давлением. Пакет ячеек состоит из кольцевых электролизных ячеек, в каждой из которых содержатся два электрода и одна щелочная неорганическая ионообменная мембрана.
Генерация H2 и O2 происходит при подаче тока на пакет ячеек. Газы затем направляются на газовый сепаратор, который представляет собой двойной сосуд под давление из нержавеющей стали, после которого они промываются в специально спроектированном напорном сосуде, расположенном над газосепаратором.
Технологическая часть поставляется как полностью собранный скид, в который включено оборудование, например:
- Пакеты ячеек
- Газосепарторы, установка промывки газообразного водорода и коалесцирующие фильтры
- Теплообменники для электролита и системы газового охлаждения
- Лоток детектора утечек с реле уровня
- Детектор водорода , панель анализатора для водорода в кислороде
- Приборы кип и распределительные коробки: датчики, трансмиттеры, реле и т.д.
- Клапаны и вентиляционные коллекторы (H2 и O2)
Блок управления
Шкаф панели управления включает в себя ПЛК и все соответствующее оборудования для обеспечения автоматической и надежной эксплуатации установки. Панель управления с помощью кабелей будет подсоединена как к технологической части, так и к силовой стойке. Характеристики:
- Утвержденный электрический кожух с 2 запираемыми дверцами
- Вентиляторы охлаждения + система фильтрации воздуха
- ПЛК (Siemens S-7 программное обеспечение)
- Снаружи: терминал с дисплеем для визуализации и HMI
- Аварийный останов на дверце кожуха
- Блок бесперебойного питания для безопасного отключения
- Источник питания 24 В пост. тока
- Автоматические выключатели и трансформаторы
- Печатные платы и звуковая сигнализация
Блок питания

Блок питания конвертирует входящей 3х фазный переменный ток в стабилизированный постоянный ток, требуемый для процесса электролиза.
Каждый блок питания может питать до 2 пакетов элементов и состоит из:
- Кожух с запираемой дверцей
- Охлаждающие вентиляторы + система фильтрации воздуха
- Защитная блокировка дверного переключателя
- ПЛК контролируется тиристорами
- Трансформатор
- Выпрямительный диод
- Автоматические выключатели, контакторы
- Измерительный пакет элементов на дверце амперметр и вольтметр
- Устройство проверки фазы
Система очистки водорода

Система очистки водорода спроектирована для дальнейшей очистки водорода до минимального уровня в размере 99.998%. Данная чистота достигается в 2 этапа:
Этап 1. Деоксидизация: для уменьшения содержания O2 в потоке газообразного H2 с помощью каталитической реакции. Выход O2 в H2 составляет менее 10 ppm или опционально менее 2 ppm.
Этап 2. Осушка: для удаления влажности в 2 колоннах осушки. Одна колонна находится в работе, в то время как вторая находится в режиме резерва / регенерации. Водород на выходе будет иметь атмосферную точку росы менее -60 °C или опционально менее -75 °C.
Система очистка водорода сконструирована на скиде и располагается в технологическом помещении. Система очистки водорода управляется с помощью центрального ПЛК в панели управления и имеет следующие особенности:
- Сосуд деокисидзации с катализатором для удаления О2 в H2 (с обогревом и изоляцией)
- Теплообменник
- Коалесцирующий фильтр
- Система дренажного сосуда для удаления воды
- Оборудование КИП
- Две колонны осушки с молекулярным ситом (с обогревом и изоляцией) (с временной регенерацией)
- Соединения до контура охлаждения газа
- Соединение до вентиляционных коллекторов технологической части (H2 и O2)
Холодильник (охлаждение газа)

Холодильник подает охлаждающую воду низкой температуры в замкнутый контур газообразного водорода и кислорода в сторону теплообменников при температуре 15 °C, вне зависимости от температуры окружающей среды. Охлажденная вода охлаждает газообразный водород и кислород, превращая водяной пар, появляющийся в процессе электролиза, в конденсат. Затем он фильтруется и удаляется из потока газа. Холодильник устанавливается внутри кожуха для применения внутри помещения и включает насос и расширительный бак.
Спецификация на чиллер
Система охлаждения электролита

Данная система охлаждения, включающая в себя насосный скид и сухой охладитель, выводит тепло в окружающий воздух.
Охлаждающая вода, как правило, водный раствор этиленгликоль, циркулирует в закрытом контуре, через высокопроизводительный теплообменник по типу «электролит-вода», установленный в технологической части установки производства водорода.
Благодаря системе охлаждения закрытого цикла гарантируется полная выходная способность установки по водороду в диапазоне температуры окружающей среды от -40 до +40°C. Сухой охладитель и насосный скид регулируются с помощью центрального ПЛК в панели управления.
Спецификация на сухой охладитель
Система подготовки питательной воды

Система подготовки питательной воды превращает водопроводную воду в чистую деминерализованную воду, необходимую для процесса электролиза. Осуществляется постоянный мониторинг за качеством воды, прежде чем она сможет поступить в процесс. Размеры ВхШхГ – 1,5х1,0х0,5 м
Система включает в себя такие фильтрационные очистные этапы как:
- Мембрана обратного осмоса
- Ионообменная система смешанного типа со смолой (2 резервуара, наполненные смолой)
- Система смягчения воды с цифровым дозирующим насосом (анти-накипь)
- Измеритель электропроводности
- Активированный уголь и предварительные фильтры для улавливания частиц
- Указатели давления и реле
Спецификация на питательную воду
Техническая спецификация
Вышеуказанные данные представлены только для информации и не могут быть использованы для гарантийных целей.
Общий вид
Дополнительные опции (по запросу)
Улучшение чистоты -75 °C 2ppm O2
Данная опция снижает атмосферную точку росы произведенного H2 с -60 °C до -75 °C, а содержание О2 в произведенном H2 с 10ppm до 2 ppm.
Уменьшенное содержание N2 – распылительный разбрызгиватель
Распылительный разбрызгиватель – это устройство, устанавливаемое на входе деминерализованной воды установки производства водорода для уменьшения содержания N2 менее 2 ppm произведенного H2.
Замер чистоты в режиме реального времени
Производится непрерывный мониторинг произведенного H2 в реальном времени как по содержанию воды («точка росы»), так и по содержанию кислорода. Данная опция может быть выбрана только в сочетании с системой очистки водорода.
Спускной клапан (только в комбинации с системой замера чистоты в режиме реального времени)
Данное устройство автоматически выпускает H2 в атмосферу, в случае если его качество не соответствует спецификации. Данная опция может быть выбрана только в комбинации с системой замера чистоты H2 в режиме реального времени.
Использование кислорода
Стандартно О2 сбрасывается в атмосферу. Производитель может обеспечить опциональную систему для очистки О2 и его подготовки для дальнейшего использования / очистки со стороны заказчика.
Система кондиционирования воздуха на панели управления
Это модульная установка кондиционирования воздуха, устанавливаемая на электропанелях. Данное устройство рекомендовано для систем, часто эксплуатируемых в температурах окруж. среды более +40 °C
Массовый расходомер
Массовый расходомер – это непосредственный замер объема H2, идущего в линию заказчика.
Содержание кислорода в детекторе атмосферы
Трансмиттер кислорода в атмосфере может быть реализован в технологическом помещении для непрерывного мониторинга уровня O2 в атмосфере технологического помещения. Система сигнализации срабатывает, если уровень кислорода падает ниже или поднимается выше безопасных предельных значений.
Автоматический перезапуск
Данная функция позволяет установке непрерывно определять актуальное давление в линии заказчика. Если установка находится в резервном режиме, то с помощью данной функции установка может быть автоматически повторно запущена, как только давление линии заказчика окажется ниже заданного порогового значения.
Опции по каркасу для наружной установки
Низкотемпературная опция:
Будут предприняты специальные действия, чтобы допустить работу при температуре окружающей среды до -40 °C. Например, адоптированная система охлаждения с закрытым контуром и усиленная система обогрева.
Аварийные огни:
В случае отключения сетевого питания аварийные огни в помещении с приборами управления будут светить до 30 минут.
Внешние огни:
Огни снаружи контейнера при входе в помещение с приборами управления / для инженерного оборудования и технологического помещения.
Вентиляционные трубы:
Две трубы из высококачественной нержавеющей стали с колпачками от дождя для безопасной вентиляции H2 и О2. Длина данных вентиляционных труб соответствует спецификации, для каркаса для наружного размещения, который установлен в зоне без прилегающих конструкций. Вентиляционные трубы должны быть вертикально соединены на месте к специально определенным фланцам на боковой стороне контейнера. Кабели обогрева для защиты труб от нулевых температур (точка замерзания) включены в данный объем.
Границы объема поставки
Границей установка электролиза является каркас для наружного размещения. На внешних стенках каркаса для наружного размещения имеются металлические пластины, которые включают следующие соединения:
- Пользователь водородного газа
- Вход питательной воды
- Вход воздуха КИП
- Вентиляционное отверстие кислорода (вентиляционная линия не включена)
- Вентиляционное отверстие водорода (вентиляционная линия не включена)
- Соединение дренажа конденсата
- Вход инертного газа (азот)
- Электрические межсоединения: включены внутри контейнера
- Механические межсоединения: включены внутри контейнера
- Энергопитание: автоматический прерыватель на стороне электролиза.
- Охлаждающая вода (2 контура):
Сухой охладитель (охлаждение электролита)
- Сухой охладитель поставляется в отдельной коробке. Он спроектирован для установки на крыше каркаса для наружного размещения, а объем поставки включает технические условия на крыше контейнера для их установки.
- Трубка обвязки и кабели для соединения контейнера к внутренней части контейнера включены, но монтаж сухого охладителя на крыше и осуществление соединений на месте осуществляются заказчиком.
Холодильник (охлаждение газа):
- Холодильник поставляется с полностью выполненными соединениями в каркасе для наружного размещения
Установка водоподготовки:
- Установка водоподготовки поставляется с полностью выполненными соединениями в каркасе для наружного размещения.
intech-gmbh.ru
Способы получения водорода в промышленности и лаборатории
Получение водорода в промышленности
В промышленности водород получают главным образом из природных и попутных газов, коксового газа и продуктов газификации топлива (водяного и паровоздушного газов), путем неполного окисления углеводородов.
Основным источником водорода в промышленности является конверсия (от лат. «превращение») углеводородов, главным образом природного газа, парами воды (пароводяная конверсия):
CH4 + H2O → CO + 3H2, 800-900 °C, ΔH2980 = 206,2 кДж/моль
С последующим каталитическим взаимодействием оксида углерода (II) с парами воды:
CO + H2O → CO2 + H2, 550-600 °C, ΔH2980 = -41,2 кДж/моль
Катализатором этой реакции служит Fe2O3 с активирующими добавками (Cr2O3, Al2O3, K2O и др.).
Эндотермичность процесса конверсии метана можно частично восполнить энергией, выделяющейся при неполном его окислении.
2CH4 + O2 → 2CO + 4H2, ΔH2980 = -71 кДж/моль
Этот процесс называется кислородной конверсией метана. Поэтому в промышленности часто комбинируют все эти три процесса в один. Для этого природный газ смешивается с водяным паром и кислородом:
3CH4 + O2 + H2O → 3CO + 7H2, 850-900 °C, Ni
или
2CH4 + O2 + 2H2O → 2CO2 + 6H2, 850-900 °C, Ni
Диоксид углерода удаляют промывкой газовой смеси водой под давлением и окончательно – поглощением растворами щелочей.
Все описанные выше процессы используются как по отдельности, так и в сочетании друг с другом.
Помимо природного газа для получения водорода путем конверсии используют генераторный (CO + N2), водяной (CO + H2) – пароводяная конверсия, попутные газы – пароводяная и (или) кислородная конверсия.
В связи с уменьшением запасов углеводородного сырья большой интерес приобретает метод получения водорода восстановлением водяного пара раскаленным углем:
C + H2O → CO + H2, 1000 °C, ΔH2980 = 131 кДж/моль
При этом образуется генераторный газ. Затраты энергии на его получение можно компенсировать за счет реакции неполного окисления угля:
C + 1/2O2 → CO, ΔH2980 = -110,5 кДж/моль
При комбинировании этих процессов получается водяной газ, состоящий в основном из смеси водорода и угарного газа:
3C + H2O + O2 → 3CO + H2
Важным следствием является то, что получаемые генераторный и водяной газы можно использовать для дальнейшего получения водорода методом пароводяной конверсии.
Из газовых смесей с большим содержанием водорода (коксовый газ, газы нефтепереработки) его получают путем глубокого охлаждения смеси, при котором практически все газы кроме водорода сжижаются.
Водород высокой чистоты получают электролизом водных растворов щелочей (NaOH или KOH). Раньше для этого использовалась серная кислота. Однако это нерационально из-за быстрого коррозионного разрушения стальной аппаратуры. Хотя образующаяся в процессе электролиза пероксодисерная кислота H2S2O8 может использоваться для получения пергидроля:
2SO42- — 2ê = S2O82-
2H+ + 2ê = H20↑
H2S2O8 + H2O = H2SO5 + H2SO4
H2SO5 + H2O = H2SO4 + H2O2
В случае щелочей концентрация этих растворов выбирается такой, которая отвечает их максимальной электрической проводимости (25% для NaOH и 34% для KOH). Электроды обычно изготавливают из листового никеля. Этот металл не подвергается коррозии в растворах щелочей, даже будучи анодом. В случае надобности получающийся водород очищают от паров воды и следов кислорода. Этим способом целесообразно получать водород в районах с дешевой электроэнергией.
Водород образуется также как побочный продукт в процессе получения хлора и щелочей электролизом водных растворов хлоридов щелочных металлов.
Потенциальные способы получения водорода в промышленности
1. Термолиз воды:
2H2O → 2H2 + O2, 2000 °C, электрическая дуга.
Недостаток – большие расходы энергии.
2. Фотолиз воды:
2H2O → 2H2 + O2, hμ
3. Биохимическое разложение воды под действием бактерий.
4. Химическое разложение воды, восстановление водорода:
H2O + X = H2 + XO
2XO → 2X + O2, t°
Получение водорода в лаборатории
Восстановление металлами и неметаллами различных водородсодержащих соединений: воды, кислот, щелочей. Чаще используется взаимодействие разбавленных кислот (соляной, серной) с цинком, реже с железом. Реакции обычно проводят в аппарате Кипа.
Zn + 2HCl = ZnCl2 + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Fe + H2SO4 = FeSO4 + H2↑
Цинк обычно содержит примеси мышьяка, сурьмы и др. элементов, поэтому выходящий из аппарата водород немного загрязнен AsH3 и др. газами. Очень чистый водород в лаборатории можно получить электролизом водных растворов щелочей.
Для получения водорода в лаборатории также можно использовать гидрид кальция:
CaH2 + 2H2O = Ca(OH)2 + 2H2↑
Пропускание паров воды через раскаленную железную трубку:
3Fe + 4H2O → Fe3O4 + 4H20↑, t°
2Al + 2NaOH + 10H2O = 2Na[Al(OH)4·2H2O] + 3H20↑
Si + 2NaOH + H2O = Na2SiO3 + 2H20↑
2Na + 2H2O = 2NaOH + H20↑
2Al + 6HCl = 2AlCl3 + 3H20↑
И проч.
himgdz.ru
Урок 26. Получение водорода и его применение – HIMI4KA
В уроке 26 «Получение водорода и его применение» из курса «Химия для чайников» узнаем о получении водорода в лабораториях и в промышленности, а также выясним в каких отраслях промышленности его применяют.


Водород находит широкое применение в технике и лабораторных исследованиях. Мировое промышленное производство водорода из меряется десятками миллионов тонн в год.
Выбор промышленного способа получения простых веществ зависит от того, в какой форме соответствующий элемент находится в природе. Водород находится в природе преимущественно в соединениях с атомами других элементов. Поэтому для его получения необходимо использовать химические методы. Эти же методы применяют для получения водорода и в лабораторной практике.
Получение водорода в лаборатории
В лабораториях водород получают уже известным вам способом, действуя кислотами на металлы: железо, цинк и др. Поместим на дно пробирки три гранулы цинка и прильем небольшой объем соляной кислоты. Там, где кислота соприкасается с цинком (на поверхности гранул), появляются пузырьки бесцветного газа, которые быстро поднимаются к поверхности раствора:
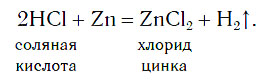
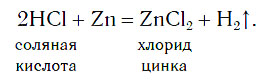
Атомы цинка замещают атомы водорода в молекулах кислоты, в результате чего образуется простое вещество водород Н2, пузырьки которого выделяются из раствора. Для получения водорода таким способом можно использовать не только хлороводородную кислоту и цинк, но и некоторые другие кислоты и металлы.
Соберем водород методом вытеснения воздуха, располагая пробирку вверх дном (объясните почему), или методом вытеснения воды и проверим его на чистоту. Пробирку с собранным водородом наклоняем к пламени спиртовки. Глухой хлопок свидетельствует о том, что водород чистый; «лающий» громкий звук взрыва говорит о загрязненности его примесью воздуха.
В химических лабораториях для получения относительно небольших объемов водорода обычно применяют способ разложения воды с помощью электрического тока:
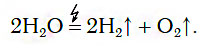
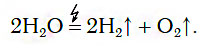
Из уравнения процесса разложения следует, что из 2 моль воды образуются 2 моль водорода и 1 моль кислорода. Следовательно, и соотношение объемов этих газов также равно:
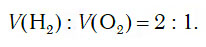
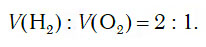
Получение водорода в промышленности
Очевидно, что при огромных объемах промышленного производства сырьем для получения водорода должны быть легкодоступные и дешевые вещества. Такими веществами являются природный газ (метан СН4) и вода. Запасы природного газа очень велики, а воды — практически неограниченны.
Самый дешевый способ получения водорода — разложение метана при нагревании:
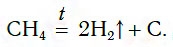
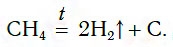
Эту реакцию проводят при температуре около 1000 °С.
В промышленности водород также получают, пропуская водяные пары над раскаленным углем:
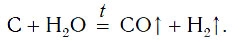
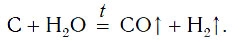
Существуют и другие промышленные способы получения водорода.
Применение водорода
Водород находит широкое практическое применение. Основные области его промышленного использования показаны на рисунке 103.
Значительная часть водорода идет на переработку нефти. Около 25 % производимого водорода расходуется на синтез аммиака NH3. Это один из важнейших продуктов химической промышленности. Производство аммиака и азотных удобрений на его основе осуществляется в нашей стране на ОАО «Гродно Азот». Республика Беларусь поставляет азотные удобрения во многие страны мира.
В большом количестве водород расходуется на получение хлороводородной кислоты. Реакция горения водорода в
кислороде используется в ракетных двигателях, выводящих в космос летательные аппараты. Водород применяют и для получения металлов из оксидов. Таким способом получают тугоплавкие металлы молибден и вольфрам.
В пищевой промышленности водород используют в производстве маргарина из растительных масел. Реакцию горения водорода в кислороде применяют для сварочных работ. Если использовать специальные горелки, то можно повысить температуру пламени до 4000 оС. При такой температуре проводят сварочные работы с самыми тугоплавкими материалами.
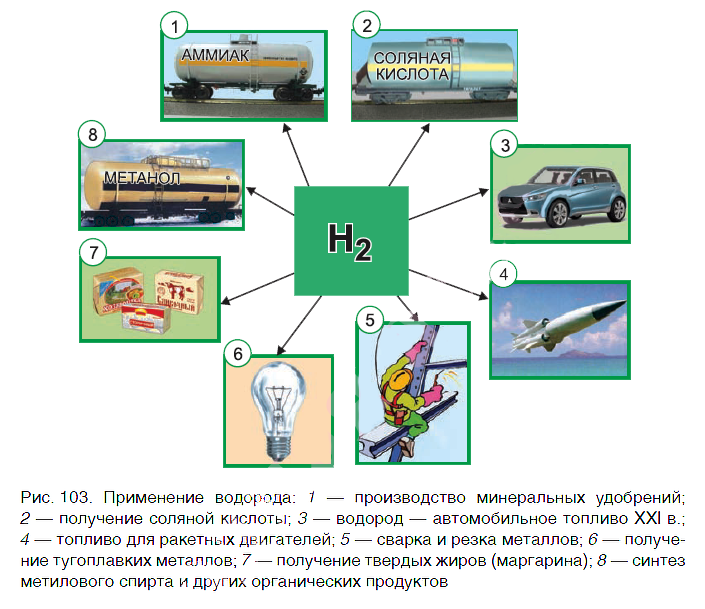

В настоящее время в ряде стран, в том числе и в Беларуси, начаты исследования по замене невозобновляемых источников энергии (нефти, газа, угля) на водород. При сгорании водорода в кислороде образуется экологически чистый продукт — вода. А углекислый газ, вызывающий парниковый эффект (потепление окружающей среды), не выделяется.
Предполагают, что с середины XXI в. должно быть начато серийное производство автомобилей на водороде. Широкое применение найдут домашние топливные элементы, работа которых также основана на окислении водорода кислородом.
Краткие выводы урока:
- В лаборатории водород получают действием кислот на металлы.
- В промышленности для получения водорода используют доступное и дешевое сырье — природный газ, воду.
- Водород — это перспективный источник энергии XXI в.
Надеюсь урок 26 «Получение водорода и его применение» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
himi4ka.ru
Получение водорода. Водородная энергетика
Водородная энергетика возникла как одна из линий развития НТП в 70-х годах предыдущего столетия. По мере расширения области исследований, касающихся получения, перевозки и хранения, а также использования водорода, становились очевиднее экологические преимущества технологий получения водорода в разных сферах народного хозяйства. Эффективность развития некоторых водородных технологий (топливные элементы, металлогидридные системы, транспортные водородные системы и т.д.) показали, что применение водорода дает совершенно новые качественные показатели в функционировании агрегатов и систем.
Проведенные технико-экономические тестирования показали, что, несмотря на то, что элемент водород – вторичный носитель энергии, то есть он дороже по стоимости, чем природные топлива, его использование в некоторых случаях экономики уже сегодня целесообразно. Поэтому работы в отрасли водородной энергетики в большинстве странах, тем более с развитой промышленностью, считаются приоритетными направлениями развития техники и науки. Они все больше поддерживаются финансами со стороны государства и частного капитала.
Свойства водорода
При нормальных условиях в свободном состоянии водород представлен бесцветным газом, не имеющим и запаха. Водород имеет плотность относительно воздуха 1/14. Обычно он встречается в комбинации с остальными элементами, например, углерода в метане, кислорода в воде, в разных органических соединениях. Поскольку водород чрезвычайно активен химически, он редко находится в несвязанном виде.
Водород, охлажденный до состояния жидкости, занимает 1/700 объема состояния в газообразном виде. При его соединении с кислородом, водород имеет максимально большое содержание энергии на одну единицу массы: 120,7 ГДж/т. Это является одной из нескольких причин, почему водород в жидком виде применяется в качестве ракетного топлива и служит энергетикой для современных космических кораблей, для которой большое удельное содержание энергии водорода и малая молекулярная масса имеет большое значение. В чистом кислороде при сжигании единственные продукты – это вода и тепло высокой температуры. Так, в случае применения водорода не выделяются вредные парниковые газы и даже не происходит нарушение в природе круговорота воды.
Производство водорода
Ресурсы водорода, которые содержатся в воде и в органическом веществе, почти неисчерпаемы. Разрыв данных связей дает возможность для получения водорода, после чего водород применяется для топлива. Разработано множество процессов по разделению воды на составные части.
Вода при нагревании более 2500°С начинает разлагаться на кислород и водород (прямой термолиз). Такую высокую температуру получают, например, при помощи концентраторов энергии солнца. Здесь проблема состоит в том, чтобы не допустить рекомбинацию кислорода и водорода.
Сегодня в мире основная часть получаемого водорода в промышленном масштабе получается в ходе паровой конверсии метана (ПКМ). Таким образом, получение водорода дает возможность применять его как реагент для процесса очистки нефти и в качестве составляющей азотных удобрений и для ракетной техники. Тепловая энергия и пар при температурах 750-800°С необходимы для выделения водорода из углеродной основы в метане, что и случается на каталитических поверхностях в химических реформерах. Самая первая ступень ПКМ процесса разделяет водяной пар и метан на моно оксид углерода, а также водород. На второй ступени в процессе «реакции сдвига» моно оксид углерода и вода преобразуются в водород и диоксид углерода. Данная реакция протекает при 200-250°С.
В СССР в 30-е годы в промышленных масштабах получали синтез-газ благодаря паровоздушной газификации угля. Сегодня в ИПХФ РАН, расположенном в Черноголовке, создается технология для газификации угля в сверхадиабатическом режиме. Данная технология дает возможность преобразовывать энергию тепла угля в тоже тепловую энергию синтез-газа с КПД 98%.
Начиная с 70-х годов предыдущего века, в нашей стране были сделаны и получили научно-техническое объяснение и подтверждение путем эксперимента проекты гелиевых высокотемпературных реакторов (ВТГР) энерготехнологических атомных станций (АЭТС) для черной металлургии и химической промышленности: АБТУ-50, а затем – проект атомной энергетической станции с реактором ВГ-400, мощность которой 1060 МВт для химико-ядерного комплекса по получению водорода и смесей, содержащих его, по выпуску метанола и аммиака, еще несколько проектов в данном направлении.
Базой для всех проектов ВТГР стали разработки ядерных двигателей для ракет на базе водорода. Испытательные высокотемпературные реакторы, выпущенные в нашей стране для данных целей, а также ядерные демонстрационные двигатели для ракет показали работоспособность при нагревании водорода до максимальной температуры 3000К.
Высокотемпературные реакторы на основе гелиевого теплоносителя – новейший тип универсальных экологически чистых атомных энергетических источников, уникальные характеристики которых – способность получать тепло при температурах выше 1000°С и высочайший уровень безопасности – определяют невероятные возможности их применения для получения в газотурбинном цикле электрической энергии с большим КПД и для обеспечения высокотемпературным теплом и электроэнергией производственных процессов получения водорода, технологических процессов нефтеперерабатывающей, химической, металлургической и других отраслей, для процессов опреснения воды.
Самым современным в этой области считается международный проект ГТ-МГР, разрабатывающийся общими стараниями отечественных институтов и компании GA из США. Также с проектом сотрудничают компании Фуджи электрик и Фраматом.
Получение атомного водорода
Источником атомного водорода являются вещества, которые отщепляют атомы водорода при их облучении. В процессе облучения ультрафиолетом, например, йодистого водорода начинает протекать реакция с выделением атомного водорода.
HI + hv® H + I
Для выделения атомного водорода используется термическая диссоциация молекулярного водорода на палладиевой, платиновой проволоке или проволоке из вольфрама, нагретой при давлении меньше 1,33 Па в атмосфере водорода. Разделения водорода на атомы удается достигнуть также, применяя радиоактивные вещества. Есть метод синтеза атомного водорода в электрическом высокочастотном разряде с дальнейшим вымораживанием молекулярного водорода.
Физические варианты способов получения водорода из смесей, содержащих его
Водород в значимых количества имеется во многих смесях газов, в коксовом газе, например, который выделяется при пиролизе бутадиена, в получении дивинила.
Чтобы выделить водород из смесей газов, содержащих водород, применяют физические методы концентрирования и выделения водорода.
Фракционирование и низкотемпературная конденсация. Данный процесс описывается высокой степенью получения водорода из газовой смеси и выгодными экономическими показателями. Как правило, при давлении газа 4 МПа для выделения 93-94%-ного водорода температура должна составлять 115К. При содержании в исходном газе водорода больше 40% степень его получения может достигать 95%. Затрата энергии на концентрирование Н2 70-90% приравнивается к 22 кВт.ч на 1000 м3 получаемого водорода.
Адсорбционное выделение. Данный процесс происходит с помощью использования молекулярных сит, адсорберов, работающих циклически. Его можно реализовывать под давлением, равным 3-3,5 МПа с извлечением до 80-85% Н2 в виде 90%-го концентрата. В сравнении с низкотемпературным способом получения водорода для осуществления данного процесса нужно приблизительно на 25-30% меньше материальных затрат и на 30-40% меньше эксплуатационных.
Адсорбционное производство водорода с использованием жидких растворителей. В некоторых случаях способ подходит для получения водорода в чистом виде. Данный метод позволяет извлекать до 80-90% водорода, который содержится в первоначальной смеси газов, а также достигать его концентрации в конечном продукте до 99,9%. Затраты энергии на получение водорода достигают 68 кВт.ч на 1000 м3 Н2.
Получение водорода путем электролиза воды
Электролиз воды – это один из распространенных и хорошо изученных способов получения водорода. Он гарантирует получение продукта в чистом виде (99,6-99,9% Н2) за одну технологическую ступень. На получение водорода в затратах на производство стоимость электроэнергии составляет около 855.
Данный способ применяется в нескольких странах, которые имеют значительные запасы недорогой гидроэнергии. Крупнейшие электрохимические комплексы располагаются в Индии, Канаде, Норвегии, Египте, но созданы и функционируют множество мелких установок в разных странах мира. Этот способ считается важным еще и потому, что он наиболее универсален относительно применения первичных энергетических источников. В связи с распространением атомной энергетики стал возможен новый расцвет процессов электролиза воды за счет недорогой электрической энергии атомных электростанций. Ресурсы электроэнергетики сегодня недостаточны для синтеза водорода как продукта для дальнейшего использования в энергетике.
Электрохимический метод получения водорода из воды имеет следующие преимущества:
1. Высокая чистота водорода в конечном продукте – до 99,99% и более;
2. Легкость и постоянство технологического процесса, можно автоматизировать процесс, в электролитической ячейке нет движущихся частей;
3. Возможность получения очень ценных дополнительных продуктов – кислорода и тяжелой воды;
4. Неисчерпаемое и доступное исходное сырье – вода;
5. Возможность получения водорода прямо под давлением;
6. Физическое распределение кислорода и водорода в ходе электролиза.
Во всех приведенных примерах получения водорода путем разложения воды побочным продуктом являются большие объемы кислорода. Это открывает новые возможности для его использования. Он сможет найти свое место не только в качестве ускорителя процессов технологии, но и в качестве незаменимого очистителя водоемов. Данная область применения кислорода может распространиться и на почву, атмосферу и воду. Сгорание в кислороде увеличивающихся количеств бытовых отходов поможет решить вопрос твердых отбросов крупных городов.
Еще один ценный продукт электролиза воды – тяжелая вода – прекрасный замедлитель нейтронов во всех атомных реакторах. Данная тяжелая вода может применяться в качестве сырья для синтеза дейтерия, который служит материалом для термоядерной энергетики.
zeleneet.com
Получение водорода
.
В ограниченном масштабе применяют способ взаимодействия водяного пара с фосфором и термического разложения углеводородов:
СН4 (1000 °С) = С + 2 Н2 (выделяется в виде газа).
В некоторых случаях водород получают в результате каталитического расщепления метанола с водяным паром
СН3ОН + Н2О (250 °С) = СО2 + 3 Н2,
или в результате каталитического термического разложения аммиака
2 NH3 (950 °С) —> N2 + 3 H2.
Однако эти исходные соединения получают в больших масштабах из водорода; между тем получение из них водорода является особенно простым и может быть использовано в таких производствах, которые потребляют его в сравнительно малых количествах (менее 500 м3/сутки).
Важнейшие методы получения водорода.
1. Растворение цинка в разбавленной соляной кислоте
Zn + 2 HCl = ZnCl2 + H2
Этот способ чаще всего применяют в лабораториях.
Вместо соляной кислоты можно также использовать разбавленную серную кислоту; однако если концентрация последней слишком высока, то выделяющийся газ легко загрязняется SO2 и H2S. При использовании не вполне чистого цинка образуются ещё и другие соединения, загрязняющие водород, например AsH3 и PH3. Их присутствие и обусловливает неприятный запах получаемого этим способом водорода.
Для очистки водород пропускают через подкисленный раствор перманганата или бихромата калия, а затем через раствор едкого кали, а также через концентрированную серную кислоту или через слой силикагеля для освобождения от влаги. Мельчайшие капельки жидкости, захваченные водородом при его получении и заключённые в пузырьках газа, лучше всего устранять при помощи фильтра из плотно спрессованной обычной или стеклянной ваты.
Если приходится пользоваться чистым цинком, то к кислоте необходимо добавить две капли платинохлористоводородной кислоты или сернокислой меди, иначе цинк не вступает в реакцию.
2. Растворение алюминия или кремния в едкой щёлочи
2 Al + 2 NaOH + 6 H2O = 2 Na[Al(OH)4] + 3 H2
Si + 2 KOH + H2O = Na2SiO3 + 2 H2
Эти реакции применяли раньше для получения водорода в полевых условиях (для наполнения аэростатов). Для получения 1 м3 водорода (при 0 °С и 760 мм рт. ст.) требуется только 0,81 кг алюминия или 0,63 кг кремния по сравнению с 2,9 кг цинка или 2,5 кг железа.
Вместо кремния также применяют ферросилиций (кремниевый метод). Смесь ферросилиция и раствора едкого натра, введённая в употребление незадолго до первой мировой войны во французской армии под названием гидрогенита, обладает свойством после поджигания тлеть с энергичным выделением водорода по следующей реакции:
Si + Ca(OH)2 + 2 NaOH = Na2SiO3 + CaO + 2 H2.
3. Действие натрия на воду
2 Na + 2 H2O = 2 NaOH + H2
Ввиду того, что чистый натрий реагирует в этом случае слишком энергично, его чаще вводят в реакцию в виде амальгамы натрия; этот способ применяют преимущественно для получения водорода, когда им пользуются для восстановления «in statu nascendi». Аналогично натрию с водой реагируют и остальные щелочные и щелочноземельные металлы.
4. Действие гидрида кальция на воду
СaН2 + 2 H2O = Сa(OH)2 + 2 H2
Этот метод является удобным способом получения водорода в полевых условиях. Для получения 1 м3 водорода теоретически необходимо 0,94 кг СаН2 и, кроме воды, не требуется никаких других реактивов.5. Пропускание водяного пара над раскалённым докрасна железом
4 Н2О + 3 Fe = Fe3O4 + 4 H2
При помощи этой реакции в 1783 г. Лавуазье впервые аналитически доказал состав воды. Образующийся при этой реакции оксид железа нетрудно восстановить до металлического железа, пропуская над ним генераторный газ так, что пропускание водяного пара над одним и тем же железом можно провести произвольное число раз. Этот метод долгое время имел большое промышленное значение. В небольших масштабах его применяют и в настоящее время.
6. Пропускание водяного пара над коксом.
При температуре выше 1000 °С реакция идёт главным образом по уравнению
Н2О + С = СО + Н2.
Вначале получают водяной газ, т. е. смесь водорода и монооксида углерода с примесью небольших количеств углекислого газа и азота. От углекислого газа легко освобождаются промыванием водой под давлением. Монооксид углерода и азот удаляют при помощи процесса Франка-Каро-Линде, т. е. сжижением этих примесей, что достигается охлаждением жидким воздухом до -200 °С. Следы СО удаляют, пропуская газ над нагретой натронной известью
СО + NaOH = HCOONa — формиат натрия.
Этот метод даёт очень чистый водород, который используют, например, для гидрогенизации жиров.
Чаще, однако, водяной газ в смеси с парами воды при температуре 400 °С пропускают над соответствующими катализаторами, например над оксидом железа или кобальта (контактный способ получения водяного газа). В этом случае СО реагирует с водой по уравнению
СО + Н2Опар = СО2 + Н2 («конверсия СО»).
Образующийся при этом СО2 поглощается водой (под давлением). Остаток монооксида углерода (~1 об. %) вымывают аммиачным раствором однохлористой меди. Применяемый в этом способе водяной газ получают пропусканием водяного пара над раскалённым коксом. В последнее время всё больше используют взаимодействие водяного пара с пылевидным углём (превращение угольной пыли в газы). Полученный таким способом водяной газ содержит обычно большое количество водорода. Выделяемый из водяного газа водород (содержащий азот) применяют главным образом для синтеза аммиака и гидрирования угля.
7. Фракционное сжиженнее коксового газа.
Подобно получению из водяного газа, водород можно получать фракционным сжижением коксового газа, основной составной частью которого является водород.
Сначала коксовый газ, из которого предварительно удаляют серу, очищают от СО2 промыванием водой под давлением с последующей обработкой раствором едкого натра. Затем постепенно освобождают от остальных примесей ступенчатой конденсацией, проводимой до тех пор, пока не остаётся только водород; от других примесей его очищают промыванием сильно охлаждённым жидким азотом. Этот метод применяют главным образом, чтобы получить водород для синтеза аммиака.
8. Взаимодействие метана с водяным паром (разложение метана).
Метан взаимодействует с водяным паром в присутствии соответствующих катализаторов при нагревании (1100 °С) по уравнению
СН4 + Н2Опар + 204 кДж (при постоянном давлении).
Необходимое для реакции тепло следует подводить или извне, или применяя «внутреннее сгорание», т. е. подмешивая воздух или кислород таким образом, чтобы часть метана сгорала до диоксида углерода
СН4 + 2 О2 = СО2 + 2 Н2Опар + 802 кДж (при постоянном давлении).
При этом соотношение компонентов выбирают с таким расчётом, чтобы реакция в целом была экзотермичной
12 СН4 + 5 Н2Опар + 5 О2 = 29 Н2 + 9 СО + 3 СО2 + 85,3 кДж.
Из монооксида углерода посредством «конверсии СО» также получают водород. Удаление диоксида углерода производят вымыванием водой под давлением. Получаемый методом разложения метана водород используют главным образом при синтезе аммиака и гидрировании угля.
9. Взаимодействие водяного пара с фосфором (фиолетовым).
2 Р + 8 Н2О = 2 Н3РО4 + 5 Н2
Обычно процесс проводят таким образом: пары фосфора, получающиеся при восстановлении фосфата кальция в электрической печи, пропускают вместе с водяным паром над катализатором при 400-600 °С (с повышением температуры равновесие данной реакции смещается влево). Взаимодействие образовавшейся вначале Н3РО4 с фосфором с образованием Н3РО3 и РН3 предотвращают быстрым охлаждением продуктов реакции (закалка). Этот метод применяют прежде всего, если водород идёт для синтеза аммиака, который затем перерабатывают на важное, не содержащее примесей удобрение — аммофос (смесь гидро- и дигидрофосфата аммония).
10. Электролитическое разложение воды.
2 H2O = 2 H2 + O2
Чистая вода практически не проводит тока, поэтому к ней прибавляются электролиты (обычно КОН). При электролизе водород выделяется на катоде. На аноде выделяется эквивалентное количество кислорода, который, следовательно, в этом методе является побочным продуктом.
Получающийся при электролизе водород очень чист, если не считать примеси небольших количеств кислорода, который легко удалить пропусканием газа над подходящими катализаторами, например над слегка нагретым палладированным асбестом. Поэтому его используют как для гидрогенизации жиров, так и для других процессов каталитического гидрирования. Водород, получаемый этим методом довольно дорог.
Применение водорода.
В настоящее время водород получают в огромных количествах. Очень большую часть его используют при синтезе аммиака, гидрогенизации жиров и при гидрировании угля, масел и углеводородов. Кроме того, водород применяют для синтеза соляной кислоты, метилового спирта, синильной кислоты, при сварке и ковке металлов, а также при изготовлении ламп накаливания и драгоценных камней. В продажу водород поступает в баллонах под давлением свыше 150 атм. Они окрашены в тёмно-зелёный цвет и снабжаются красной надписью «Водород».
Водород используется для превращения жидких жиров в твердые (гидрогенизация), производства жидкого топлива гидрогенизацией углей и мазута. В металлургии водород используют как восстановитель оксидов или хлоридов для получения металлов и неметаллов (германия, кремния, галлия, циркония, гафния, молибдена, вольфрама и др.).
Практическое применение водорода многообразно: им обычно заполняют шары-зонды, в химической промышленности он служит сырьём для получения многих весьма важных продуктов (аммиака и др.), в пищевой — для выработки из растительных масел твёрдых жиров и т. д. Высокая температура (до 2600 °С), получающаяся при горении водорода в кислороде, используется для плавления тугоплавких металлов, кварца и т. п. Жидкий водород является одним из наиболее эффективных реактивных топлив. Ежегодное мировое потребление водорода превышает 1 млн. т.
mirznanii.com
Способы получения водорода | Сварка и сварщик
Технический водород получают в промышленности:
- электролизом воды;
- методом глубокого охлаждения газовых смесей, содержащих водород;
- железо-паровым способом;
- из водяного газа путем окисления содержащейся в нем окиси углерода водяным паром в присутствии катализатора;
- в специальных водородных генераторах воздействием серной кислоты на железную стружку и цинк.
На первых порах источником для получения водорода служили кислоты. Так и в наше время в лабораториях часто получают его средневековым способом — действием цинка на серную кислоту. Реакция протекает по уравнению:
Zn + H2SO4 = ZnSO4 + H2
Вместо цинка можно взять железо в виде стружек или алюминий. Водород получается, загрязненный побочными продуктами разложения серной кислоты, и, если это требуется, его приходится очищать.
Огромные количества водорода, необходимые современной промышленности, получают сейчас электролизом раствора щелочи и извлекают из промышленных газов — коксовальных печей, газов, получаемых при переработке нефти и др.
При переработке каменного угля на кокс дополнительно получается деготь и коксовый газ. В состав газа входит до 50-60% водорода (H2), 20-25% метана (СН4), окись углерода (СО), азот (N) и др.
В статье «Гелий — солнечный газ» описан процесс получения гелия методом фракционной конденсации. Так же поступают и с коксовым газом. Но чтобы отделить водород от других составных частей, требуется очень глубокое охлаждение из-за низкой критической температуры водорода.
Наиболее широко распространенным способом получения водорода является — электролиз дистиллированной воды. В результате чего получают водород, кислород и некоторые примеси.
Единственным исходным сырьем для получения водорода электролитическим методом служит вода. Чистая, дистиллированная вода обладает огромным сопротивлением и почти совершенно не проводит электрический ток. Вот почему для того чтобы сделать воду электропроводной, в ней нужно растворить какую-нибудь соль, кислоту или основание, которые дают ионы.
Через водный раствор щелочи (например: каустическая сода) пропускают постоянный электрический ток. При этом вода разлагается, и на отрицательном электроде (катоде) выделяется водород, а на положительном электроде (аноде) — кислород, также являющийся важным промышленным продуктом. В результате получения 2 м3 водорода, как побочный продукт получается 1 м3 кислорода. Большой расход электроэнергии является главным недостатком данного способа, поэтому применение водорода полученного при помощи электролиза целесообразно при одновременном использовании вместе с кислородом. В связи с этим в последнее время портативные водородные сварочные аппараты для газовой сварки и пайки пользуются все большей популярностью.
weldering.com
